口罩出口貿易措施指南 附各國進口條件(1/2) 外貿B2B、B2C
各國註冊、認證簡要辦理流程
美國NIOSH認證
需按照NIOSH的指南實施,企業需寄送樣品至NIOSH實驗室實施測試,同時提交技術性資料(包括品質體系部分資料)至NIOSH文審,只有文審和測試都通過,NIOSH才核發批准。NIOSH將其認證的防顆粒物口罩分為9類,具體的測試則由NIOSH下屬的NPPTL (National Personal Protective Technology Laboratory)實驗室操作。主要測試指標包括呼氣阻力測試、呼氣閥洩漏測試、吸氣阻力測試、過濾效率測試。
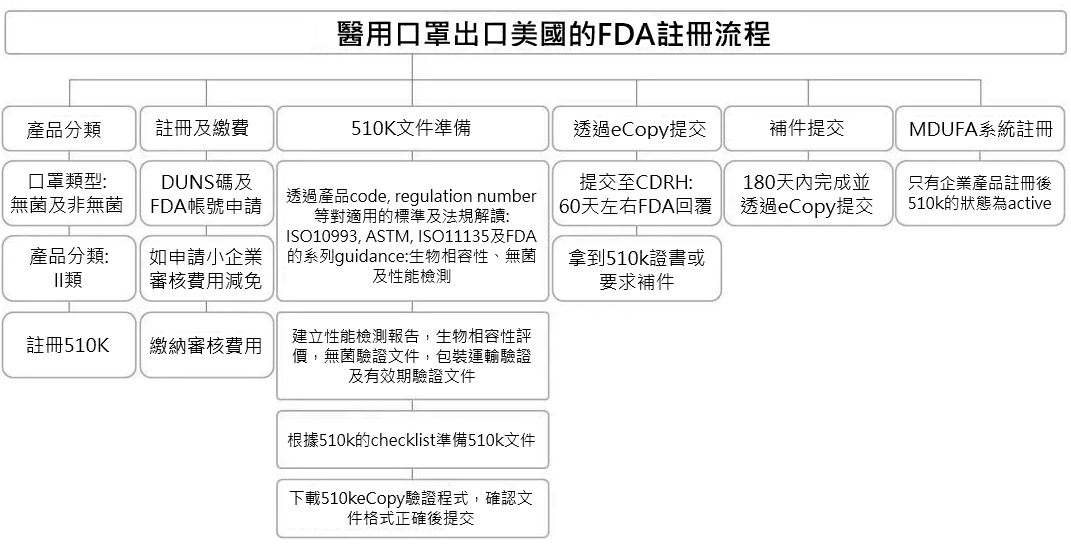
美國FDA註冊
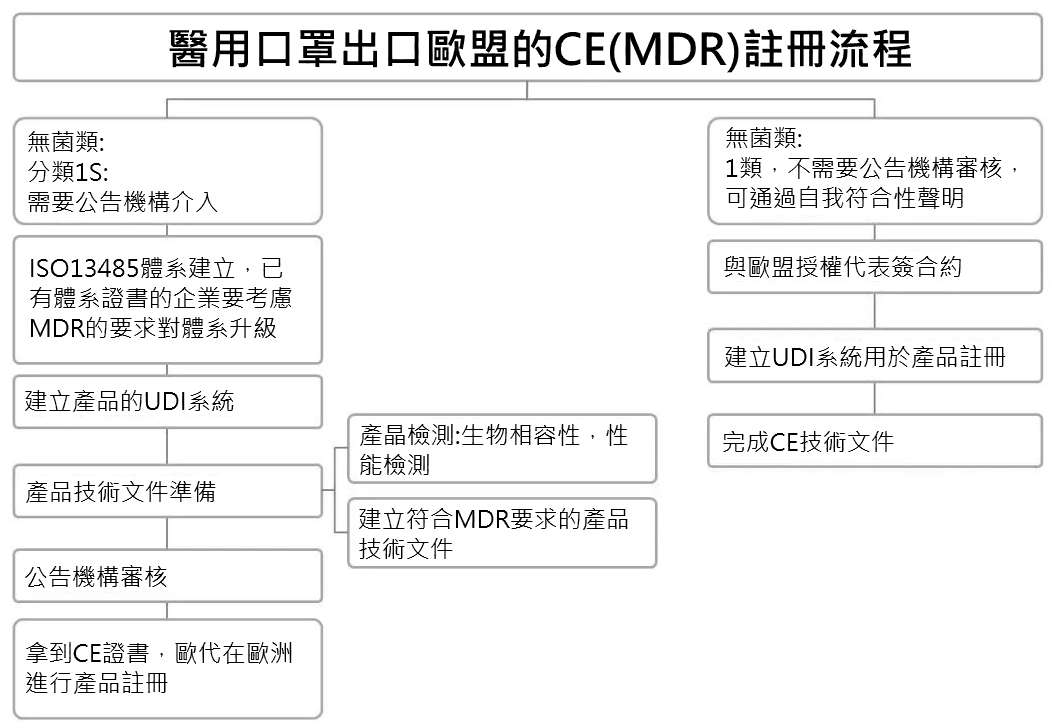
歐盟CE註冊
日本PMDA註冊
- 準備階段。確定產品分類(I,II特殊控制,II類控制,III,IV)和產品JMDN編碼,選擇MAH(日本持證方);
- 製造商向PMDA註冊工廠;
- II類特殊控制產品向授權認證機構PCB申請QMS工廠審核,其他II類產品和III類IV類產品向PMDA申請QMS工廠審核,並獲得QMS證書;
- 申請Pre-Market Apporval證書,II類特殊控制由PCB發證,其他II類產品和III類IV類產品控制由MHLW(厚生勞動省)發證;
- 支付申請費用;
- 註冊文件整改,註冊批准;
- 所有類別產品均需要MAH向RBHW(厚生省地區機構)進行進口通報註冊後才能進口銷售。
韓國KFDA註冊
韓國衛生福利部(MinistryofHealthandWelfare,MHW),簡稱衛生部,主要負責管食品、藥品、化妝品和醫療器械的管理,是最主要的衛生保健部門。依照《醫療器械法》,韓國衛生福利部下屬的食品藥品安全部負責對醫療器械的監管工作。KFDA註冊流程為:
- 確定產品分類(I,II,III,IV),選擇KLH(韓國持證方);
- II類產品需申請KGMP證書和接受現場審核,II類產品一般是授權的協力廠商審核員,並獲得KGMP證書;
- II類產品需要送樣品到韓國MFDS授權的實驗室進行韓國標準的測試;
- 由KLH向MFDS(韓國食品藥品安全部)提交技術檔(檢測報告,KGMP證書等),進行註冊審核;
- 支付申請費用;
- 註冊文件整改,註冊批准;
- 指定韓國代理商和經銷商,產品銷售。
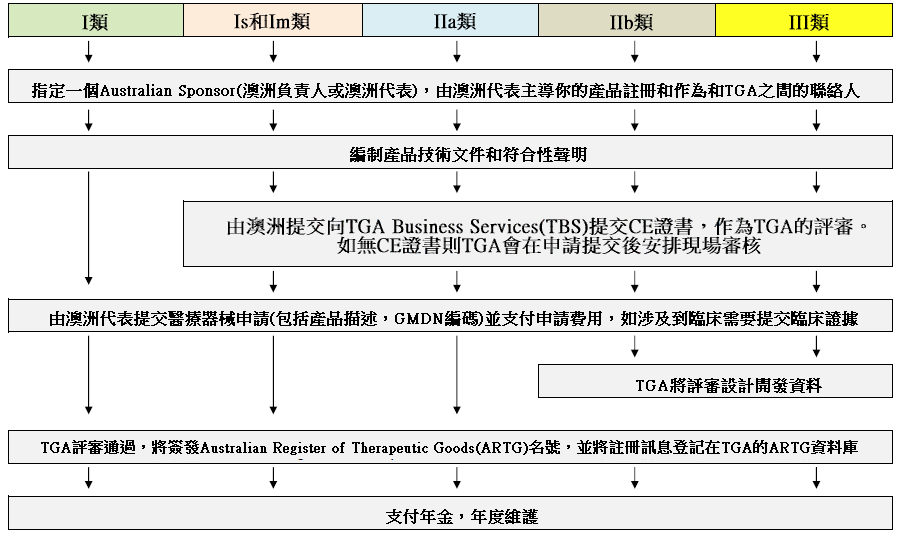
澳大利亞TGA註冊
依據Australian Therapeutic Goods (Medical Devices) Regulations 2002,澳大利亞對醫療器械分為I類,Is and Im, IIa, IIb, III類,產品的分類幾乎和歐盟分類一致,如果產品已經獲得CE標誌,則產品類別可以按照CE分類。如果已經獲得歐盟公告機構(Notified Body)簽發的CE證書,是可以被TGA認可的,並可作為滿足澳大利亞安全法規的重要註冊資料。
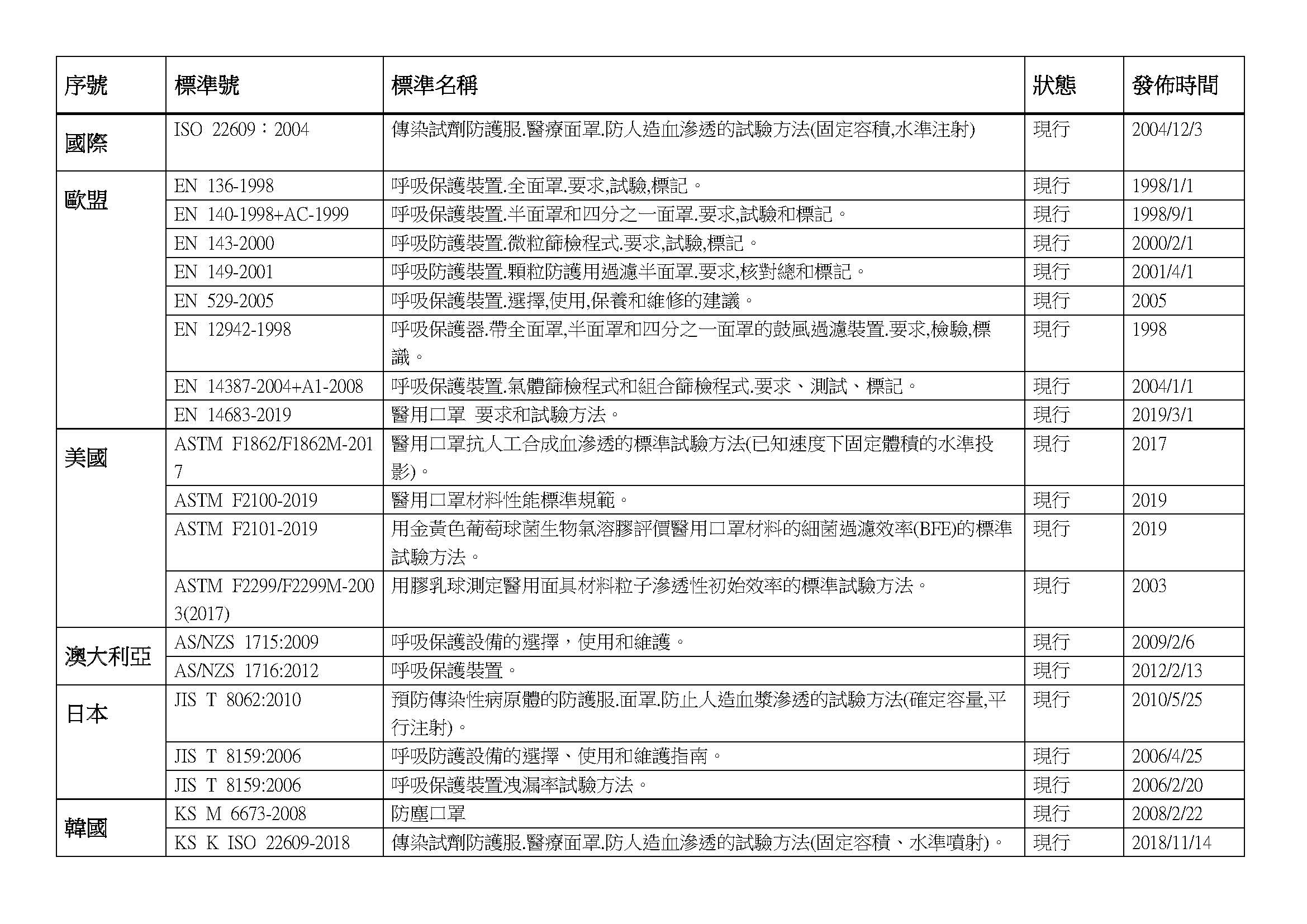
各國口罩技術標準
(供生產企業參考)
Tradesparq是一家專業的國際貿易資訊商業競爭情報服務商,可以提供您產品在國外市場的潛在”匹配”客戶詳細交易記錄
想了解更多(預約演示服務免費)👉https://pse.is/MRADC
想學更多?
https://gozens.pse.is/全球市場B2B2C免費說明會
🏆所有近期公開課程列表
https://gozens.net/所有近期公開課程列表
🏆開課時間/地點無法配合您的需求?
請填此表>>>https://goo.gl/VjfDWJ,小編幫您湊班!